유전자 조작 생쥐모델 이용, 아밀로이드 축적을 억제하는 자가포식 역할 규명
국내 연구진이 당뇨병 환자의 90% 이상에서 관찰되는 아밀로이드* 축적에 의한 2형 당뇨병**의 발병을 억제하는 자가포식***의 기능을 규명했다.
나아가 자가포식이 결핍된 췌장소도 세포에서는 아밀로이드가 축적, 당뇨병을 유발한 반면, 자가포식이 증진된 췌장소도세포에서는 아밀로이드의 축적이 억제되고, 혈당이 개선됨을 밝혀, 향후 2형 당뇨병 치료제 개발에 기여할 것으로 기대된다.
* 아밀로이드 : 세포 조직 내에 축적되는 불용성 단백질 덩어리로, 뇌 조직 내에 아밀로이드가 축적되어 발병하는 알츠하이머병이 대표적 아밀로이드성 질환임
** 2형 당뇨병 : 보통 성인에서 보는 당뇨병으로 소아나 청소년에서 주로 발생하는 자가면역성 1형 당뇨병과는 달리, 기본적으로 대사질환이며 경구 당뇨병약으로 치료한다. 2형 당뇨병 환자의 90% 이상에서 췌장 소도에 아밀로이드가 축적되어 있다.
*** 자가포식 : 세포 내 손상된 분자나 세포소기관 등을 제거하는 정화작용으로 노화, 퇴행성 신경질환, 대사질환, 감염/면역질환 등과의 관련성이 보고되고 있음
삼성서울병원 이명식 교수 연구팀(제1저자 성균관대 삼성융합의과학원 석박사 통합과정 김진영 연구원)이 삼성의료원과 울산의대 강상욱 교수 연구팀과 공동으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 글로벌연구실(Global Research Lab)사업 등의 지원을 받았고, 연구결과는 기초?임상의학 분야 국제학술지 임상연구저널(Journal of Clinical Investigation) 온라인판 7월 18일자에 게재되었다. (논문명 : Amyloidogenic peptide oligomer accumulation in autophagy-deficient β cells induces diabetes)
일반적으로 90% 이상 당뇨병 환자의 췌장세포에서는 알츠하이머 환자의 뇌 조직에서 보이는 것과 흡사한 아밀로이드가 축적되어 있으며, 이는 당뇨병의 발병에 직접적인 영향이 있을 것으로 생각되어 왔다. 그러나 비정상적인 아밀로이드의 축적 과정이나 이를 제거하는 방법은 알려지지 않고 있었다.
연구팀은 변성된 단백질을 제거하는 자가포식이 아밀로이드의 축적을 억제하여 당뇨병을 치료할 수 있을 가능성에 착안하였고, 사람과 같은 형태의 아밀로이드를 생산할 수 있는 유전자를 발현하는 유전자 조작 생쥐에서 자가포식이 일어나지 못하도록 함으로써, 당뇨병이 발생하는 것을 발견하였다.
즉, 축적된 아밀로이드를 자가포식으로 제거하지 못하면 인슐린을 분비하는 췌장세포가 손상되고 결국 인슐린 분비가 줄어 당뇨병을 유발할 수 있다는 것이다.
실제 자가포식이 일어나지 않는 생쥐는 정상생쥐에 비해 혈중 인슐린 농도가 낮게 나타났다. 아밀로이드와 hIAPP* 중합체가 자가포식으로 제거되지 못해 세포에 손상을 주는 것이다.
* hIAPP (human Islet amyloid polypeptide) : 인간 췌장소도에서 분비하는 아밀로이드 중합체로 인슐린과 함께 분비되는 아미노산 37개의 펩타이드 호르몬이다. 생쥐의 IAPP와 달리 hIAPP중합체 및 아밀로이드를 형성한다.
반면 이 생쥐에 자가포식을 증진시킬 수 있는 물질(trehalose)을 투여하자 아밀로이드 축적이 줄어들면서 당뇨 증상이 호전되는 것으로 나타났다.
이 교수는 "자가포식 조절제가 당뇨병 치료제로의 개발될 수 있는 가능성을 보여주는 것으로 아밀로이드 축적이 관찰되는 알츠하이머 등 퇴행성 신경질환에도 같은 원리가 적용될 수 있을 것”이라고 내다봤다.
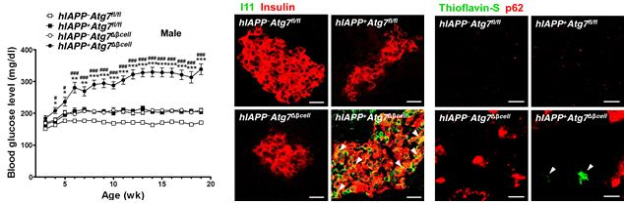
그림 1. 자가포식 결핍 생쥐모델에서의 당뇨증상과 hIAPP oligomer 및 amyloid 축적
(왼쪽) 자가포식 결핍 생쥐의 혈당
췌장소도세포에서 자가포식이 결핍된 hIAPP 발현 생쥐모델(검정색 원 그래프, hIAPP+Atg7Δβcell)에서만 혈당이 상승하는 것으로 나타났다.
(가운데) hIAPP oligomer 축적
특이항체(I11)를 이용한 면역형광염색 결과 자가포식이 결핍된 hIAPP 발현 생쥐모델(오른쪽 아래 패널, hIAPP+Atg7Δβcell)에서만 hIAPP oligomer 축적(연두색)이 관찰되었다.
(오른쪽) 아밀로이드 축적
화합물(thioflavin-S)을 이용한 화학형광염색 결과 자가포식이 결핍된 hIAPP 발현 생쥐모델(오른쪽 아래 패널, hIAPP+Atg7Δβcell)에서만 아밀로이드 축적(연두색)이 관찰되었다.
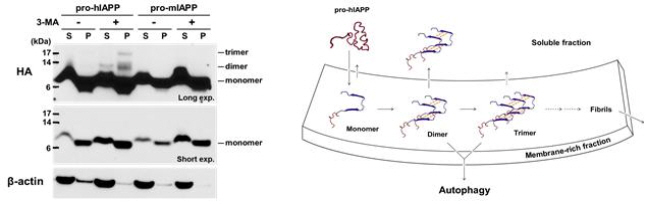
그림 2. hIAPP 이합체와 삼합체 형성
(왼쪽) INS-1(Rat insulinoma cell line) 세포에 hIAPP와 mIAPP를 발현하는 DNA벡터를 주입하고 24시간 뒤, 자가포식 저해제 3-MA(3-methyladenin)를 처리하여 24시간 추가배양한 후 세포를 파쇄하여 들어있는 단백질을 분석한 결과, hIAPP 벡터를 주입한 세포에서만 이합체 (Dimer)와 삼합체 (Trimmer)가 관찰되었고(왼쪽, 맨 위 3-4번 레인), 자가포식 저해제(3-MA)를 처리한 세포에서 자가포식에 의한 hIAPP 제거가 저해되어 hAIPP 양이 증가하는 것이 관찰되었다(왼쪽, 맨 위 1-4번 레인). 삼합체의 경우, 수용성 분획(S)에서는 관찰되지 않지 않았고, 막 풍부 불용성 분획(P)에서만 관찰되었다(왼쪽, 맨 위 4번 레인).
(오른쪽) hIAPP 이합체와 삼합체 형성 모델 제안
hIAPP 이합체(Dimer)는 수용성 분획보다 막이 풍부한 분획(membrane-rich fraction)에서 형성될 가능성이 높으며 이합체 중 일부는 수용성 분획(soluble fraction) 으로 이동하고, 다른 나머지는 막 풍부 분획에서 삼합체(Trimmer)를 형성한다. 이합체와 삼합체는 자가포식(autophagy)에 의해 제거된다.
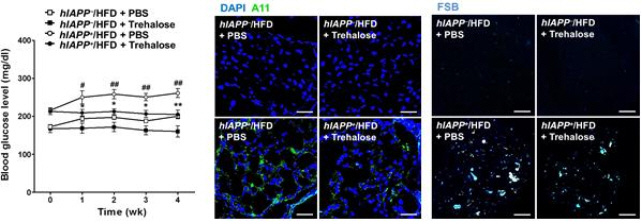
그림 3. 생쥐에서의 자가포식 증진에 의한 당뇨 개선 효과
(왼쪽) 자가포식 증진하는 Trehalose에 의한 혈당개선 효과
매주 혈당을 측정한 결과, 비만을 유발하는 고지방사료(HFD; High fat diet)를 먹은 hIAPP 발현 생쥐(hIAPP+)에 자가포식을 증진시키는 것으로 알려진 trehalose를 주3회 주사한 생쥐(검정색 원 그래프, hIAPP+/HFD + Trehalose)에서 대조군에 비해 혈당이 개선되는 것이 관찰되었다.
(가운데) hIAPP oligomer 축적
Aβ 및 hIAPP oligomer 특이 항체(A11)를 이용한 면역형광염색법을 실시한 결과 동일한 타입의 생쥐(오른쪽 아래 패널, hIAPP+/HFD + Trehalose)에서 hIAPP oligomer(연두색)가 감소한 것이 관찰되었다.
(오른쪽) 아밀로이드 축적
FSB를 이용한 화학형광염색시 동일한 타입의 생쥐(오른쪽 아래 패널, hIAPP+/HFD + Trehalose)에서 아밀로이드(파란색) 축적이 감소한 것이 관찰되었다.
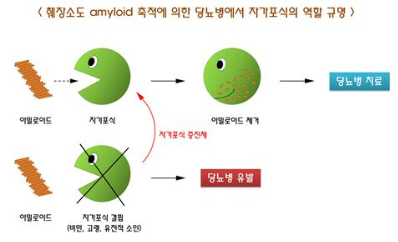
그림 4. 췌장소도 아밀로이드 축적에 의한 당뇨병에서 자가포식의 역할 규명 모식도
자가포식을 증진시키면(위) 아밀로이드가 제거되고 자가포식이 저하되면(아래) 아밀로이드가 축적되면서 췌장소도세포 사멸과 당뇨병이 유발되는 원리를 이용해 당뇨병 치료의 실마리를 찾을 수 있을 것으로 기대된다.
이명식 교수[교신저자] 이력사항

1. 인적사항
○ 소 속 : 성균관대학교(삼성서울병원)
○ 전 화 : 02-3410-3436
○ 이메일 : ms0923.lee@samsung.com
2. 학력
○ 1981.02 : 서울대학교 의과대학 졸업(의학사)
○ 1984.02 : 서울대학교 대학원 의학과(석사)
○ 1990.08 : 서울대학교 대학원 의학과(박사)
3. 경력사항
○ 1982.02 ~ 1985.02 : 서울대학교병원 내과 전공의
○ 1992.02 ~ 1995.08 : 미국 Scripps Research Institute
○ 1995.09 : 삼성서울병원 내분비내과
○ 1997.03 ~ 2002.03 : 성균관 의과대학 내과 부교수
○ 2002.04 ~ 현재 : 성균관 의과대학 내과 교수
4. 전문분야정보
○ 당뇨병, 자가포식, 면역/염증
5. 연구지원정보
○ 2010 ~ 현재 : 미래창조과학부?한국연구재단 글로벌연구실(GRL)사업
www.newssports25.com
전재표 기자 su1359m@hanmail.net
기사 제보 및 보도자료/ 스포츠닷컴&추적사건25시











 학원·입시 정보 한 눈에… 학원뉴스닷컴 21일 오픈
학원·입시 정보 한 눈에… 학원뉴스닷컴 21일 오픈
















