헬리코박터균에 의한 암세포의 운동성 획득과정 규명, 위암 예방을 위한 실마리 제공 기대
국내 연구진이 헬리코박터균*에 의한 위암** 진행 원리를 찾아냈다. 위암 예방을 위한 치료법 개발에 기여할 것으로 기대된다.
* 헬리코박터균(Helicobacter pylori) : 편모를 가진 나선형 세균으로, 위장점막에 주로 감염되어 위염, 위궤양, 십이지장 궤양, 위선암, 위림프종 등을 유발하는 원인으로 작용한다.
** 위암 : 위에 생기는 악성종양으로 대개 위선암(gastric adenocarcinoma)을 말함. 우리나라에서 남녀 모두 가장 흔하게 발생하는 암으로 전체 암의 20% 가량 차지
연세대학교 의대 이용찬, 치대 육종인, 치대 김현실 교수 연구진이 주도한 이번 연구는 미래창조과학부가 추진하는 중견연구자지원사업(도약) 등의 지원을 받아 수행되었고, 연구결과는 국제학술지 네이처 커뮤니케이션스(Nature Communications)지 온라인판 7월 23일자에 게재되었다.
(논문명 : Helicobacter pylori CagA promotes Snail-mediated epithelial?mesenchymal transition by reducing GSK-3 activity)
헬리코박터균의 종양단백질(CagA*)이 발암과정에 관여하는 것은 알려져 있었으나 자세한 분자생물학적 원리에 대해서는 알지 못했다.
* CagA : 헬리코박터균의 주요 유독인자(major virulence factor)로 작용하는 종양단백질
연구팀은 헬리코박터균이 가진 종양단백질(CagA)이 암세포의 상피간엽이행*을 촉진하여 위암이 진행됨을 알아냈다.
* 상피간엽이행(EMT,epithelial?mesenchymal transition) : 암세포의 침윤성 성장 및 전이시 주변세포와의 부착을 끊고 혈관이나 림프관을 타고 이동하기 위해 세포간 결합이 느슨해지고 세포의 골격이 변하며 운동성을 획득하는 현상.
종양단백질(CagA)이 인산화효소(GSK-3*)를 억제하여 상피간엽이행을 유도하는 단백질(Snail**)을 분해하지 못하고 안정화시킴으로써 위암이 진행된다는 것이다.
* GSK-3 : 모든 세포에서 상시 활성형태로 존재하는 다기능의 단백질 세린/트레오닌 인산화효소(serine/threonine kinase). 건강한 세포에서는 GSK-3 활성에 의해 Snail이 억제되지만, 암세포에서는 Snail을 억제하지 못한다.
** Snail : 세포-세포 사이 부착물질(adhesion molecule)인 E-cadherin의 전사를 억제하여 세포부착을 소실시켜 전이에 관여하는 것으로 알려진 단백질
실제 헬리코박터균이 없는 경우와 달리 헬리코박터균이 있는 위염 환자조직 위 점막 상피에서 핵 내 단백질(Snail) 발현이 증가했다.
종양단백질(CagA)에 의한 상피간엽이행 촉진이 헬리코박터균에 의한 염증과 위암 발생과정의 분자학적 연결고리임을 밝힘으로써 단백질(Snail)을 표적으로 하는 화합물 발굴 등 관련 연구가 활발해질 것으로 기대된다.
이용찬 교수는 “이번 연구를 통해 위암 예방을 위한 치료법 개발에 새로운 가능성을 열었다”고 밝혔다.
연 구 결 과 개 요
1. 연구배경
위암은 한국인에게 발생하는 암중 가장 흔한 암으로서 한국과 일본에서 암으로 인한 사망원인의 수위를 차지하고 있다. 세계보건기구(WHO)에서 Helicobacter pylori(H. pylori)를 위암의 유발인자로 발표하였다. 기존 H. pylori 연관 연구는 대부분 소화성궤양이나 만성위염 등의 병태생리에 초점을 맞추어 왔지만 21세기에 들어서면서 H. pylori 와 위암의 관련성이 점차 밝혀지고 있다.
현재 가장 각광받는 위암 연관단백질은 H. pylori 가 생산하는 CagA 단백질이다. 이전부터 소화성궤양이나 위암의 환자에서 얻은 H. pylori 의 대부분이 CagA를 생산한다는 점에서 병원인자로서의 CagA의 생물학적 의의가 임상역학적으로 주목받았다. 하지만 CagA를 생산하는 H. pylori 와 위암이 어떻게 관련되는지를 설명할 수 있을 만한 중요한 분자생물학적 기전은 아직 해명되지 않았다.
사람을 만성 감염시키는 세균에서 세균단백질이 직접 세포 안으로 이행하는 현상이 발견된 것은 H. pylori 가 최초이며, 최근 CagA transgenic mouse 실험에서는 48주 이후 소화기내 polyp이 발생하고 72주에 많은 선암(adenocarcinoma)이 발생하여 H. pylori에 의한 암 발생과정에서 CagA가 특이적인 역할을 수행하는 것으로 증명은 되었으나 (PNAS, 2008, 105, 1003), 구체적인 위암 발병 및 진행 기전은 아직 알려져 있지 않다.
위암의 진행 과정에는 상피간엽이행(EMT, epithelial?mesenchymal transition)이 동반된다. EMT는 암세포의 재발과 전이의 생물학적 기전이며 E-cadherin 전사억제 인자인 Snail 발현 조절이 암세포의 EMT와 침윤성 성장에 있어 중심적인 역할을 담당한다. Snail 유전자는 β-catenin과 유사한 GSK-3 인산화 motif를 가지고 있고, 대표적인 암발생 신호전달체계인 Wnt 신호전달에 의해 β-catenin 및 Snail 인산화 조절이 동시에 수행된다고 알려져 있다.
2. 연구내용
본 연구에서는 기존 연구와 달리 CagA에 의한 Wnt 및 GSK/Snail 신호 전달 조절을 규명함으로써 기존에 설명되지 않았던 H. pylori에 의한 위암 진행 기전을 규명하고자 하였다.
o H. pylori는 위암세포주에서 CagA에 의존적으로 EMT를 유도하고 Snail 단백질의 발현을 안정화시킴
위암세포주에서 CagA 존재 시 암세포의 이동 및 in vivo embryonic chick chorioallantoic membrane(CAM) assay 상의 침윤(invasion)이 증가함을 관찰하였고, Snail 단백질은 안정화되는 반면, snail의 전사인자인 E-cadherin은 mRNA 수준에서 억제되었다.
o CagA는 GSK-3와 결합하여 활성을 억제하고, GSK-3에 의한 Snail 분해를 억제함으로써 EMT를 억제함
CagA에 의한 Snail의 조절은 CagA가 GSK-3와 결합하여 불용성 분획(insoluble fraction)을 형성하여 GSK-3 활성을 억제하기 때문이며, 따라서 GSK-3에 의한 Snail 인산화 및 잇따른 Snail의 분해 과정이 억제됨으로써 EMT가 억제된다.
o 인체에서 H. pylori infection 감염 시 Snail 발현이 증가되어 있음을 증명
위염 환자조직 중 헬리코박터균이 없는 조직에 비해 헬리코박터균이 있는 조직에서 Snail 단백질 발현이 통계적으로 유의하게 증가되어 있음을 밝혀냈다. 이는 헬리코박터균에 의한 염증 반응과 위암 발생 과정에서 CagA가 중요한 고리역할을 함을 의미한다.
3. 기대효과
헬리코박터균에 의한 한국인 위암의 발병과 진행 기전에 대한 이해를 돕고 위암 예방법 개발에 새로운 가능성을 제시할 것으로 기대된다.
그 림 설 명
ㅇ그림 1. 위암 세포에서 헬리코박터균 종양단백질 CagA에 의한 암세포 침윤 유도
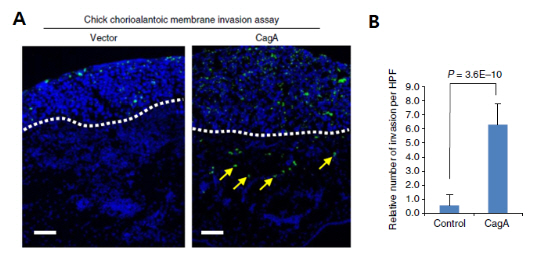
A. 비침윤성 유방암상피세포주(MCF-7)에 녹색형광을 띠는 GFP와 control과 CagA를 각각 일시적으로 발현시킨 다음, embryonic chick chorioallantoic membrane(CAM, 흰색 점선) 상방에 3일간 배양하고 고정하여 형광현미경 관찰을 통해 암세포의 침윤을 관찰한 결과, CagA 처리군(오른쪽)에서 Control(왼쪽)과 달리 암세포가 흰색 점선을 넘어 이동하는 침윤이 유도(노란색 화살표) 된 것을 볼 수 있다.
B. CAM 하방 GFP에 양성을 보이는 세포에 대해 Student’s t-test를 시행한 결과 통계적으로 유의하게 CagA 처리군에서 암세포 침윤이 유도됨을 나타낸다.
ㅇ그림 2. CagA/GSK-3 결합에 의한 Snail 조절
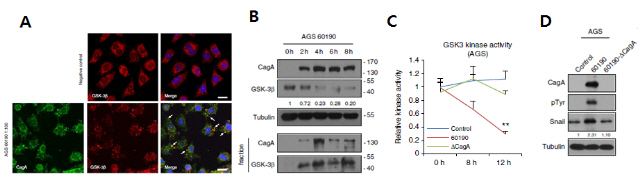
A. 위암세포주(AGS)에 HA-tagged GSK-3β 벡터를 발현시키고, control(위쪽 그림)과 CagA 양성 균주 60190를 각각 감염시킨 후(아래쪽 그림) 형광현미경으로 관찰한 결과(anti-CagA(녹색), anti-HA(붉은색), DAPI (파란색))으로 관찰하면, CagA와 GSK-3β의 발현 패턴이 일치하는 것을 볼 수 있다.
B. CagA 양성 균주 60190을 감염시킨 경우 시간에 따른 CagA와 GSK-3β의 단백질 발현을 soluble fraction과 insoluble fraction의 변화를 분석하면, CagA와 결합 후 GSK-3β의 insoluble fraction이 증가함을 확인하였다.
C. CagA 양성 균주 60190를 감염시킨 경우 GSK-3β의 인산화효소 활성은 줄어듦.
D. CagA 양성 균주 60190를 감염시킨 경우 Snail 단백질은 안정화됨.
ㅇ그림 3. 위염 환자조직에서 헬리코박터균 감염에 의한 Snail의 발현 유도
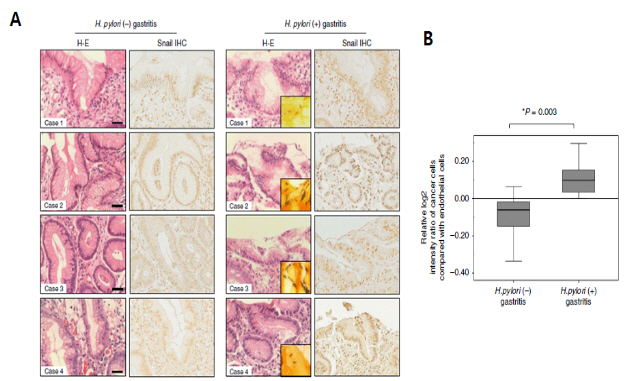
A. 헬리코박터균이 발견된 위염 환자 조직(삽입된 작은 그림: Warthin?tarry staining)에 대한 면역화학염색결과 Snail 단백질의 발현이 증가되어 있는 것을 볼 수 있다.
B. Aperio Scanscope에서 얻은 디지털 이미지를 대상으로 Student’s t-test 시행한 결과, 통계적으로 유의하게 H. pylori (+) gastritis 환자의 위조직 상피세포에서 핵 내 Snail 단백 발현이 증가함을 나타낸다.
이용찬 교수[교신저자] 이력사항

1. 인적사항
○ 소 속 : 연세대학교 의과대학
○ 전 화 : 02-2228-1960
○ 이메일 : leeyc@yuhs.ac
2. 학력
○ 1981.03~1987.02 : 연세대학교 의과대학 의학과
○ 1988.03~1990.08 : 연세대학교 의과대학 의학석사
○ 1991.03~1998.03 : 연세대학교 의과대학 의학박사
3. 경력사항
○ 2003.03~2008.02 : 연세대학교 의과대학 부교수
○ 2008.03~현 재 : 연세대학교 의과대학 교수
○ 2007.11~현 재 : 연세대학교 세브란스병원 식도암전문클리닉 팀장
○ 2013.03~현 재 : 연세대학교 세브란스병원 내시경실 실장
4. 전문분야정보
○ 헬리코박터 파일로리 매개 위암화 기전연구, 위암줄기세포 특성규명 및 임상적용, 위암의 조직진단 및 치료술 개발. 위장관 미생물균총 특성규명 및 바이오마커 개발
5. 연구지원정보
○ 2009~2011 : 교육과학기술부?한국연구재단 일반연구자지원사업(기본연구)
www.newssports25.com
전재표 기자 su1359m@hanmail.net
기사 제보 및 보도자료/ 스포츠닷컴&추적사건25시











 제24회 나라꽃 무궁화 전국축제 개최
제24회 나라꽃 무궁화 전국축제 개최













